Ingenieurdienstleistungen und Qualifizierung
| Zeitraum: | Projekte: | Standorte: |
 |
| 2004 - heute | Projekte in der pharmazeutischen Großindustrie | Hessen, Baden-Württemberg, Schweiz | |
| Projektumfang: |
|
||
| Für die Prozesse: |
|
||
|
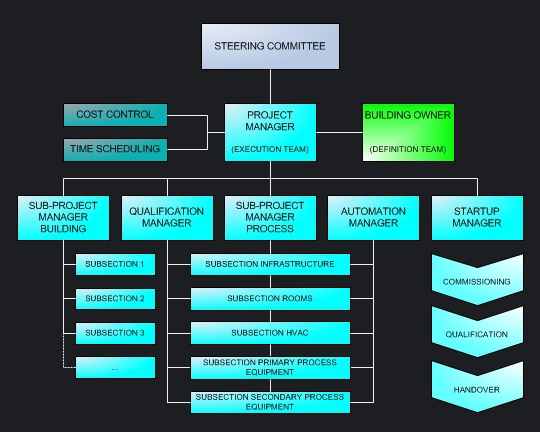
In großen Pharmakonzernen bilden globale Engineering-Richtlinien die Vorgaben für das Projektmanagement und standortspezifische Ausführungsvorschriften den Rahmen zur inhaltlichen Abwicklung der Projekte. Im Rahmen dieser Projekte werden einzelne Gewerke oder ganze Prozesse von externen Fachplanern betreut. |
|||
|
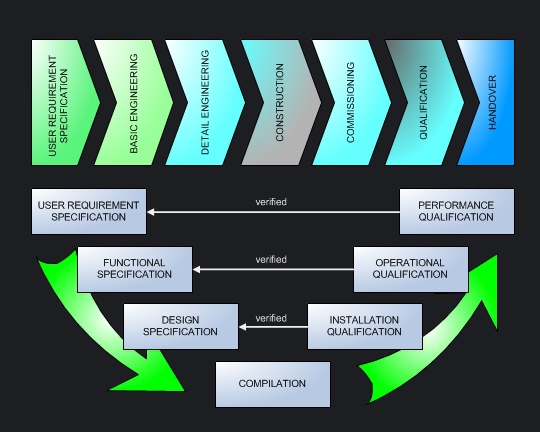
Parallel zu den einzelnen Projektphasen wird die Qualifizierung entsprechend einem aus der Softwareentwicklung stammenden V-Modell geplant und durchgeführt. Europäisch geprägte Unternehmen führen häufig eine umfangreiche Designqualifizierung durch und fordern Lieferantenspezifikationen darum oft bereits in einer sehr frühen Phase des Projekts. |
 |
| Zeitraum: | Projekte: | Standorte: |
 |
| 1990 - 2003 | Projekte im pharmazeutischen Mittelstand | Niedersachsen | |
| Projektumfang: |
|
||
| Für die Prozesse: |
|
||
|
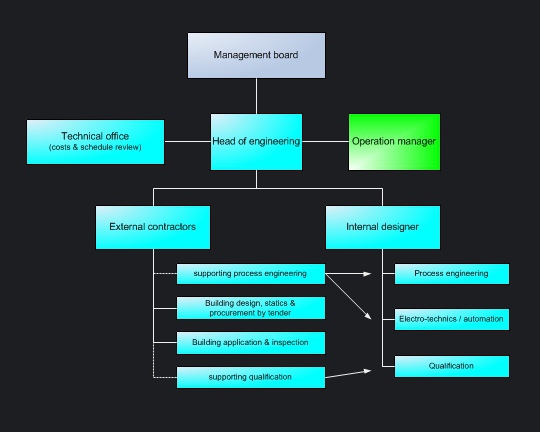
In konzernfreien, mittelständische Pharmaunternehmen werden Projekte in der Regel vom Technischen Leiter „on the job“ abgewickelt. Das Projektteam wird häufig mit Mitarbeitern aus den eigenen Reihen besetzt. Spezifische Fachplanungsleistungen werden von externen Planungsunternehmen zugekauft. |
|||
|
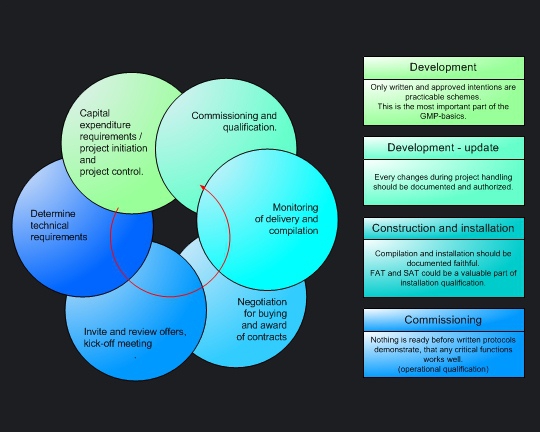
Deutlich schlankere Unternehmensstrukturen, deutlich kleinere Projektorganisationen und das Fehlen konzernweiter Richtlinien ermöglichen kürzere Entscheidungswege. Dennoch erfüllen auch die im Mittelstand abgewickelten Projekte alle erforderlichen GMP-Richtlinien. Die Projektabwicklungen orientieren aus dem GMP-Blickwinkel sich an fünf einfachen Leitsätzen:
|
 |
|
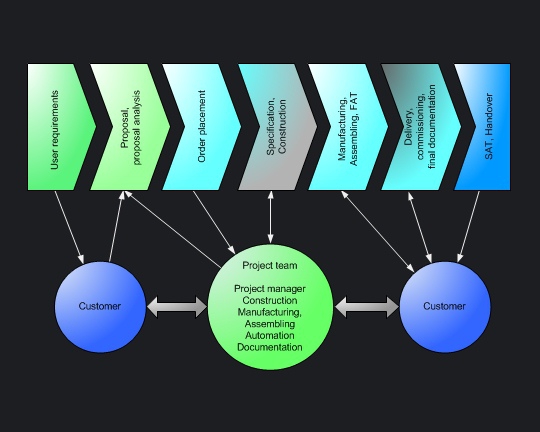
Wer Investitionsgüter in Pharmaunternehmen liefert, muss sich also sowohl in den Strukturen der global operierenden Konzerne als auch im pharmazeutischen Mittelstand auskennen. Was auch immer Ihr jeweiliger Kunde bei Ihnen kaufen möchte, die Projektphasen
werden maßgeblich von der Einhaltung der einschlägigen GMP-Richtlinien bestimmt. Je mehr Prozessverständnis ein Lieferant mitbringt und je deutlicher das eigene GMP-Profil hervortritt, umso größer ist sein Wettbewerbsvorteil. |
 |
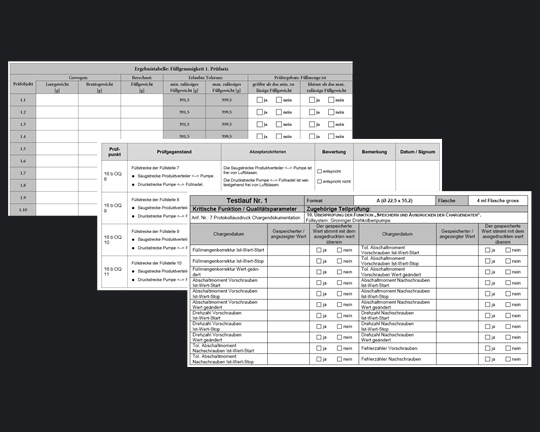
QualifizierungWas auch immer Sie Ihrem jeweiligen Kunden liefern, die Dokumentation Ihrer
wird maßgeblich von der Einhaltung der einschlägigen GMP-Richtlinien bestimmt. Je deutlicher ein Lieferant das eigene GMP-Profil zu dokumentieren in der Lage ist, umso größer ist sein Wettbewerbsvorteil. |
 |
